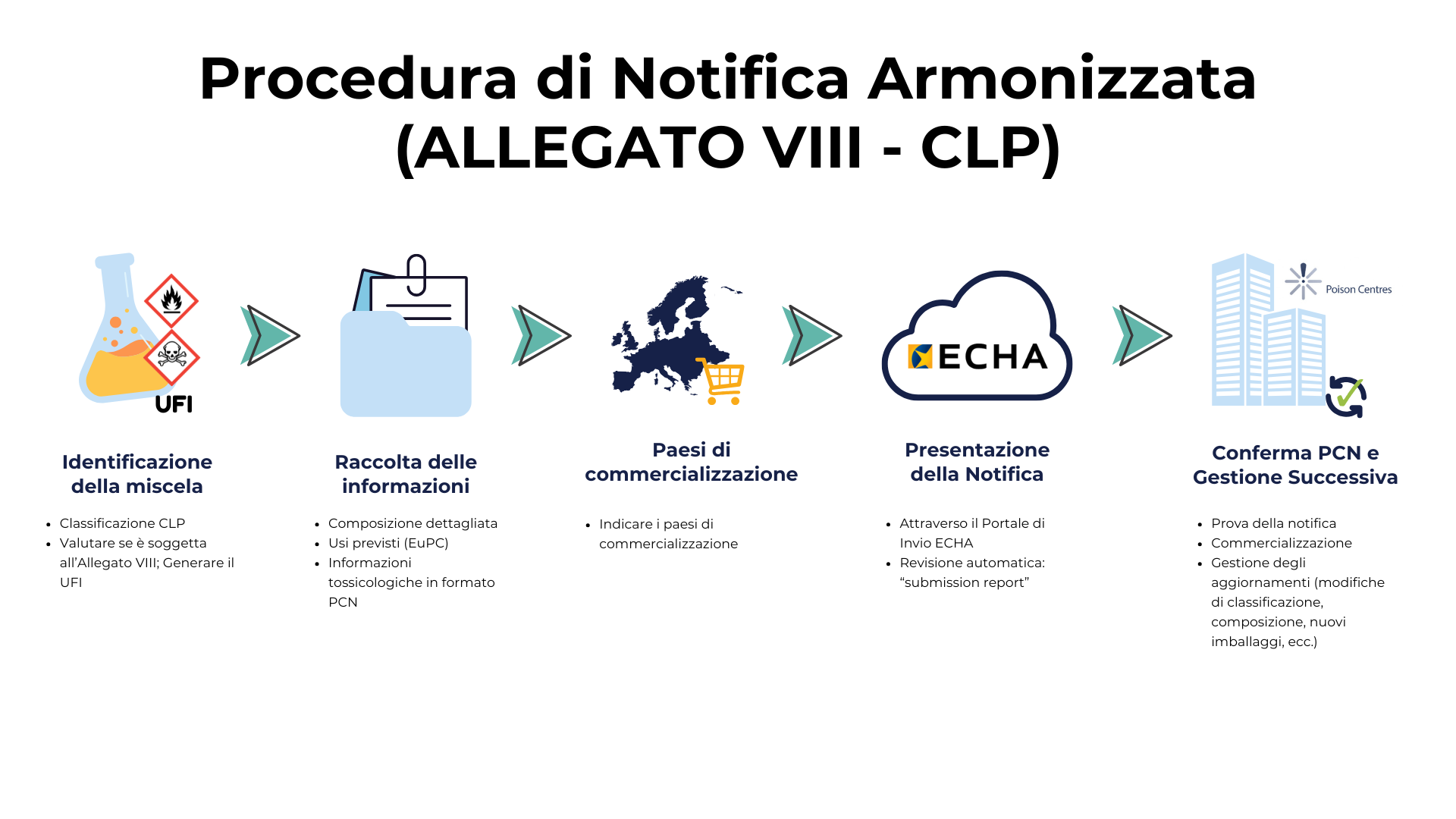
Allegato VIII del CLP: Notifica Armonizzata ai Centri Antiveleni
Dal 1° gennaio 2025, è obbligatorio utilizzare il formato armonizzato per le notifiche ai Centri di Informazione Tossicologica (PCN) nell'Unione Europea. Questa disposizione si applica a tutte le miscele pericolose immesse sul mercato europeo che presentano un pericolo fisico e/o per la salute, in conformità con l'Allegato VIII del CLP, Regolamento (CE) n. 1272/2008 sulla Classificazione, Etichettatura e Imballaggio.
Se commercializzi miscele pericolose e desideri sapere quali prodotti devono essere notificati o aggiornati, quali passaggi seguire per conformarti alla normativa, proteggere gli utenti ed evitare rischi legali per la tua azienda, questo articolo è per te. Continua a leggere!
In cosa consiste la notifica armonizzata dell'Allegato VIII del CLP?
La notifica armonizzata è la procedura mediante la quale si comunica ai Centri di Informazione Tossicologica la composizione e le caratteristiche delle miscele pericolose, seguendo un formato comune in tutta l'Unione Europea.
Questo obbligo rientra nell'articolo 45 del Regolamento CLP, che richiede agli Stati membri di designare organismi responsabili di ricevere informazioni rilevanti per la risposta sanitaria in caso di emergenza. L'articolo specifica inoltre che tali informazioni devono essere presentate secondo quanto stabilito nell'Allegato VIII del CLP. Il documento dettaglia i requisiti tecnici, il formato armonizzato e i dati necessari per garantire una risposta efficace da parte dei servizi di emergenza.
In sintesi, mentre l'articolo 45 stabilisce "chi" e "perché", l'Allegato VIII si occupa di "come". L'obiettivo finale di questa armonizzazione è migliorare la qualità, la coerenza e la disponibilità delle informazioni sulle miscele pericolose, facilitando un intervento rapido e adeguato in situazioni di esposizione o incidente chimico.
Quando una miscela è commercializzata in più paesi dello Spazio Economico Europeo, deve essere notificata per ciascuno di essi attraverso il sistema armonizzato stabilito dall'ECHA. Tuttavia, alcuni Stati membri possono avere requisiti specifici complementari (come la lingua, i termini o il pagamento di tasse), il che implica prestare attenzione a particolarità normative di ciascun paese.
Mi riguarda?
Con il Regolamento (UE) 2024/2865 (novembre 2024), sono stati introdotti aggiustamenti al Regolamento CLP. In particolare, è stato ampliato l'ambito dell'articolo 45, stabilendo che i responsabili della notifica sono gli utilizzatori intermedi, gli importatori e i distributori che commercializzano miscele pericolose nell'Unione Europea.
I distributori che commercializzano, ri-etichettano o cambiano il marchio di queste miscele dovranno presentare le stesse informazioni agli organismi designati quando distribuiscono i prodotti in altri Stati membri, a meno che non possano dimostrare che tali informazioni sono già state presentate dagli importatori o utilizzatori intermedi.
Inoltre, è fondamentale tenere presente che la notifica è un requisito preliminare per la commercializzazione della miscela. Ciò è particolarmente rilevante quando il prodotto è commercializzato da un terzo distinto dall'importatore o dall'utilizzatore intermedio.
Per quali miscele devo presentare informazioni?
L'obbligo di notifica armonizzata si applica a tutte le miscele pericolose immesse sul mercato classificate per i loro effetti sulla salute umana e/o per pericoli fisici.
È importante sottolineare che questa disposizione include anche i biocidi e i prodotti fitosanitari, che rientrano nell'ambito di applicazione del Regolamento CLP. In questi casi, i requisiti di notifica si aggiungono agli obblighi specifici già stabiliti nel Regolamento sui biocidi e nel Regolamento sui prodotti fitosanitari, pertanto è fondamentale considerare tutte le normative applicabili durante la preparazione della documentazione.
Esistono prodotti esclusi?
Sono esclusi dall'ambito di applicazione del CLP (articolo 1 del Regolamento CLP), e quindi dalla notifica armonizzata:
Miscele radioattive
Miscele sottoposte a supervisione doganale
Sostanze intermedie non isolate
Miscele destinate alla ricerca e allo sviluppo scientifico, non commercializzate
Rifiuti
Miscele destinate all'utente finale, si riferisce al "prodotto finito" (medicinali, medicinali veterinari, prodotti cosmetici, dispositivi medici, alimenti o mangimi: additivi alimentari, aromatizzanti, additivi nei mangimi, alimentazione animale).
Cosa deve includere la notifica?
La notifica prevista nell'Allegato VIII del CLP consiste nella creazione di un dossier che deve rispettare una serie di requisiti stabiliti dal formato PCN. Di seguito, ti spieghiamo gli elementi più rilevanti:
Composizione esatta
Il dossier deve includere la composizione dettagliata della miscela, specificando:
Le sostanze presenti e la loro concentrazione
Classificazione CLP
Informazioni tossicologiche rilevanti
UFI – Identificatore Unico di Formula
L'UFI (Unique Formula Identifier) è un codice alfanumerico obbligatorio che deve apparire sia sull'etichetta del prodotto che nel dossier. Questo identificatore collega le informazioni del prodotto alla notifica presentata, facilitando la tracciabilità in caso di incidente.
EuPCS
Il sistema EuPCS (European Product Categorisation System) è un sistema europeo di categorizzazione dei prodotti. Questa classificazione consente di identificare l'uso previsto della miscela (ad esempio: detergente per bagno, vernice, adesivo, ecc.). Selezionare correttamente l'EuPCS è fondamentale, poiché aiuta i Centri Antiveleni a interpretare rapidamente il tipo di prodotto.
Paesi di commercializzazione
Un altro elemento essenziale del dossier è l'indicazione dei paesi in cui la miscela sarà commercializzata. Questo dato determina a quali Centri Antiveleni nazionali verranno inviate le informazioni.
Dove devo notificare?
Dal 1° gennaio 2025, ogni miscela che comporta un pericolo fisico e/o per la salute e che è sul mercato deve essere stata notificata seguendo il formato PCN e presentata tramite il Portale di Presentazione dell'ECHA. Inoltre, da questa data, l'unica procedura valida per presentare le notifiche è quella armonizzata.
Come si presentano le notifiche?
Le notifiche delle miscele pericolose ai Centri Antiveleni secondo l’Allegato VIII del Regolamento CLP possono essere presentate in diversi modi: le aziende possono preparare e inviare le loro notifiche PCN utilizzando il software IUCLID o altri software compatibili che permettono la creazione di dossier nel formato richiesto, inviandoli tramite il canale System-to-System (S2S). Una volta elaborato, il dossier può essere trasmesso direttamente all’Agenzia europea per le sostanze chimiche (ECHA).
L’S2S è un “connettore” che consente a un software specializzato di inviare i dossier al portale dell’ECHA, garantendo efficienza, tracciabilità e continuo rispetto normativo.
Lo schema seguente riassume il flusso di presentazione delle notifiche mediante la preparazione del dossier PCN con IUCLID o altro software compatibile e il suo invio attraverso il canale S2S direttamente all’ECHA. Infine, l’Agenzia lo rende disponibile ai Centri Antiveleni indicati nella notifica.
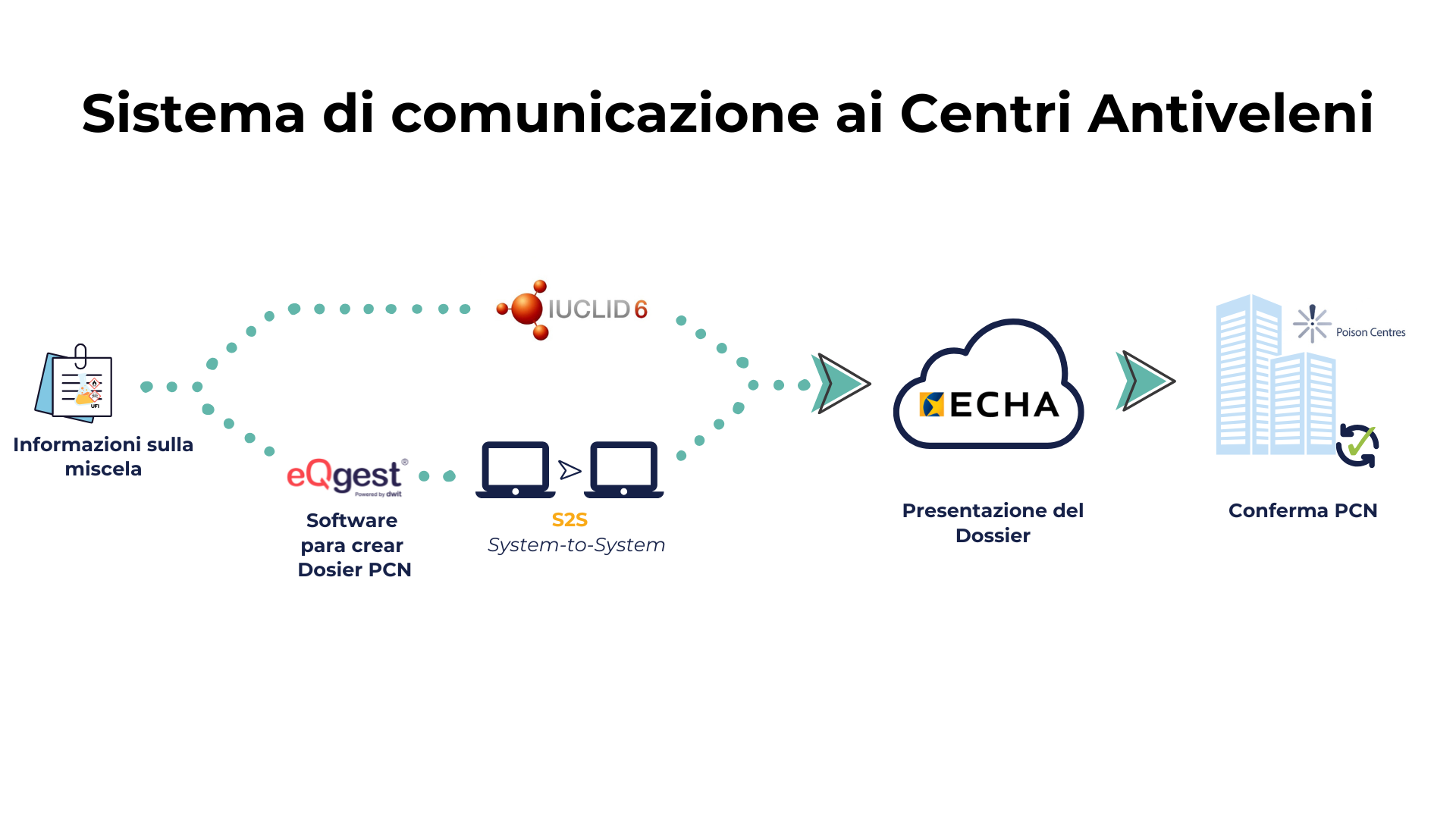 Questo è il processo di notifica armonizzata conforme all’Allegato VIII del Regolamento CLP.
Questo è il processo di notifica armonizzata conforme all’Allegato VIII del Regolamento CLP.
In questo contesto, eQgest offre una soluzione avanzata e perfettamente adattata a questi requisiti. Dal 2018, l’azienda dispone di un modulo specifico per la notifica ai centri tossicologici, pienamente conforme alla normativa vigente e progettato per facilitare la creazione e l’invio dei dossier in formato PCN.
Se la tua azienda non dispone ancora del nostro modulo per la notifica ai Poison Centres, sei ancora in tempo per implementare un’integrazione agile, efficace e senza complicazioni. Il nostro sistema è compatibile con il canale System-to-System (S2S), permettendoti di gestire direttamente l’invio dei dossier tramite eQgest, con totale efficienza, tracciabilità e conformità normativa.
Contattaci e scopri come semplificare la gestione delle tue notifiche con uno strumento professionale, intuitivo e in costante evoluzione.Así es el proceso de notificación armonizada conforme al Anexo VIII del Reglamento CLP.
Cosa può succedere durante il processo di notifica?
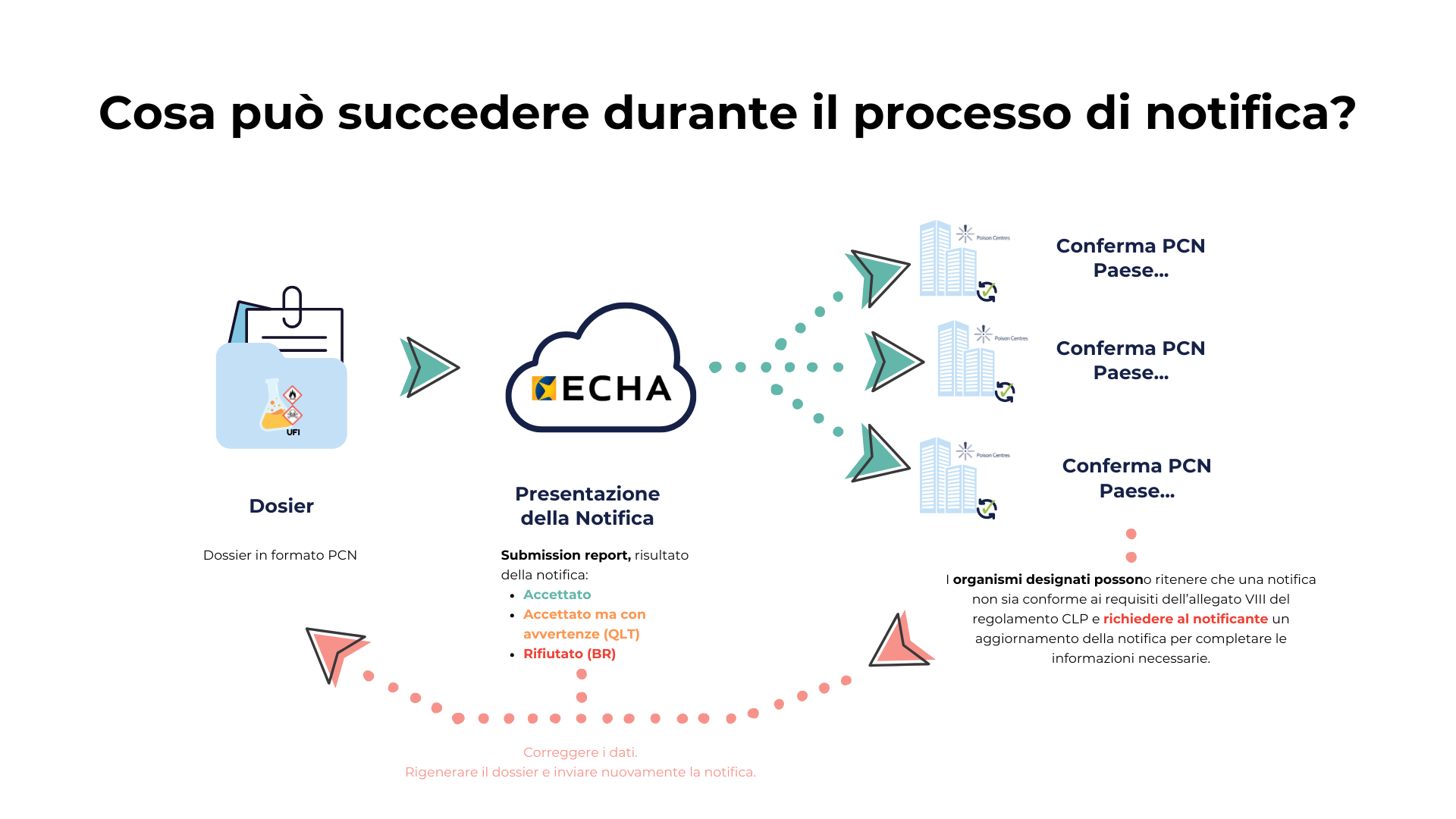
Una volta che hai preparato e inviato il tuo dossier di notifica di una miscela pericolosa tramite il portale ECHA, possono verificarsi diversi scenari. Ecco i più comuni e cosa comportano:
Submission report accettata: nel migliore dei casi, l’ECHA genera un rapporto di presentazione (ECHA Submission Report) indicando che il dossier ha superato la revisione automatica ed è stato inviato correttamente ai Centri Antiveleni.
Submission report con avvertenze (QLT): anche se il dossier è stato accettato, il rapporto può contenere avvertenze sulla qualità (QLT - Quality rule). Queste indicano incoerenze o potenziali lacune nelle informazioni. Sebbene non impediscano la presentazione, si consiglia di correggerle per evitare richieste di aggiornamento future da parte dei Centri Antiveleni.
Submission report con errore di presentazione (BR): in alcuni casi, la revisione automatica rileva errori che impediscono l’invio del dossier ai Centri Antiveleni. Questo succede quando non si rispettano le regole aziendali (BR - Business Rules) dell’ECHA. In questo caso, il dossier viene respinto e deve essere corretto e inviato nuovamente.
Revisione successiva da parte degli organismi designati nazionali: anche se il dossier è stato accettato dall’ECHA, i Centri Antiveleni degli Stati membri possono richiedere modifiche se rilevano informazioni incomplete, confuse o incoerenti. In tal caso, dovrai aggiornare il dossier e ripresentarlo con le modifiche richieste.
Lo schema seguente riassume il flusso di cosa può succedere durante il processo di notifica armonizzata:
 Per evitare ritardi o ulteriori invii, assicurati di rivedere attentamente il contenuto del dossier prima della presentazione. L’uso di strumenti di validazione preventiva e l’attenzione alle avvertenze può farti risparmiare tempo e complicazioni.
Per evitare ritardi o ulteriori invii, assicurati di rivedere attentamente il contenuto del dossier prima della presentazione. L’uso di strumenti di validazione preventiva e l’attenzione alle avvertenze può farti risparmiare tempo e complicazioni.
Per facilitare il processo e aiutarti a rispettare i requisiti fin dall’inizio, il modulo specifico per il formato PCN di eQgest guida l’utente secondo le esigenze del formato, aiutando a garantire che il tuo dossier sia allineato con i requisiti dell’Allegato VIII del CLP prima della presentazione. Questo riduce il rischio di errori e previene contrattempi inutili.
Qui puoi consultare nel dettaglio le avvertenze sulla qualità (QLT) e le regole aziendali (BR) che possono influenzare la tua notifica.
Organismi nazionali designati
Per ogni Stato membro dell’Unione Europea esiste un organismo nazionale designato, responsabile della gestione delle informazioni tossicologiche relative alle miscele pericolose.
A questo link fornito da ECHA è possibile consultare l’elenco completo di questi organismi, insieme ai relativi dati di contatto, per chiarire qualsiasi dubbio legato alla notifica armonizzata.
Inoltre, l’ECHA ha pubblicato un documento dettagliato che spiega come ogni paese implementa gli aspetti chiave dell’Allegato VIII del Regolamento CLP, compresi aspetti come tariffe applicabili e requisiti specifici a livello nazionale.
Paesi collegati al portale ECHA
Attualmente, i seguenti paesi sono pienamente connessi al portale europeo di notifica armonizzata, il che significa che accettano le notifiche tramite l’ECHA Submission Portal senza necessità di canali aggiuntivi o nazionali:
Austria
Belgio
Bulgaria (notifica a livello nazionale)
Croazia
Cipro
Repubblica Ceca
Danimarca
Estonia
Finlandia
Francia
Germania
Grecia
Ungheria
Islanda
Irlanda
Italia
Lettonia
Lituania
Liechtenstein
Lussemburgo
Malta
Paesi Bassi
Norvegia
Polonia
Portogallo
Romania
Slovacchia
Slovenia
Spagna
Svezia
Anche in questo link è disponibile un elenco completo degli organismi nazionali designati da ciascuno Stato membro dell’UE, con i dati di contatto.
Queste informazioni sono particolarmente utili per ottenere il numero di telefono di emergenza del centro antiveleni, da includere nella sezione 1.4 della Scheda di Sicurezza (SDS).
Cosa succede con le notifiche già presentate prima del formato armonizzato?
Tutti i prodotti devono essere aggiornati al formato armonizzato, non è previsto alcun trasferimento automatico dei dati dalle notifiche non armonizzate (notifiche effettuate direttamente ai centri antiveleni). Tuttavia, se il prodotto cessa di essere fabbricato prima del termine del periodo di transizione (1° gennaio 2025), non sarà necessario presentare una nuova notifica.
Cosa succede con le Notifiche Armonizzate già presentate prima dell’utilizzo di eQgest?
Nessun problema: è possibile importare queste notifiche precedenti in eQgest per disporre di una tracciabilità completa e centralizzata di tutto ciò che è stato comunicato all’ECHA.
Questo ti permetterà di gestire in modo unificato sia le notifiche precedenti che quelle future, mantenendo il controllo e facilitando eventuali aggiornamenti o modifiche.
Ricevi aggiornamenti normativi direttamente via email
Newsletter con normative chimiche aggiornate, notizie regolatorie del settore e prossimi webinar — selezionati per professionisti come te.


.png)
.png)